研究者の方へ
再生医療等の実施手続き
この手続きの対象は、臨床研究、自由診療による再生医療等の提供です。治験の場合は薬機法に基づき、通常の治験と同様の手続きに従ってください。
学外について第3種再生医療等の審査は原則として受け付けておりません。
再生医療等の実施を検討する前に、関連法規等をご確認ください。
- 関連法規(厚生労働省-再生医療について)
- 再生医療等の安全性の確保等に関する法律
(平成25年法律第85号) - 再生医療等の安全性の確保等に関する法律施行令
(平成26年8月8日政令第278号) - 再生医療等の安全性の確保等に関する法律施行規則
(厚生労働省令第110号) - 再生医療等の安全性の確保等に関する法律等に関するQ&Aについて
(平成26年11月21日事務連絡) - 再生医療等提供計画等の記載要領等について
(平成26年11月21日事務連絡)
- 再生医療等の安全性の確保等に関する法律
- 予め細胞培養加工施設についての手続きを完了しておいてください。
- 国内の医療機関等以外で製造を行う場合:許可
- 国外で製造を行う場合:認定
- 国内の医療機関等内で製造を行う場合:届出
※細胞加工施設ごとの手続きが必要です。
特定認定再生医療等委員会
- 九州大学病院特定認定再生医療等委員会
設置者:九州大学総長 石橋 達朗
認定番号:NA8150001
有効期間:令和3年4月17日から令和6年4月16日まで
委員会開催日
日時 提出締切 場所 第88回 令和6年4月30日(火)
15:00~4月16日(火) ウエストウイング棟
6階 613会議室第89回 令和6年5月29日(水)
15:00~5月15日(水) ウエストウイング棟
6階 613会議室第90回 令和6年6月26日(水)
15:00~6月12日(水) ウエストウイング棟
6階 613会議室※都合により、急遽予定変更される場合がありますが、あらかじめご了承願います。
- 九州大学再生医療等提供計画に関する審査等業務受託規程
- 特定認定再生医療等委員会での審査フロー
- 委員名簿 2024年4月現在
- 特定認定再生医療等委員会議事概要
再生医療等実施の流れ
1.再生医療等提供計画の作成
再生医療等提供計画案の作成
特定認定再生医療等審査委員会への申請には下記の書類が必要です。
- 再生医療等提供計画(厚労省様式1)
作成支援サイト:https://saiseiiryo.mhlw.go.jp/application/plan - 提供する再生医療等の詳細を記した書類
- 実施責任者及び再生医療等を行う医師/歯科医師の氏名、所属、役職及び略歴(研究実績があるには、その実績)を記載した書類
- 細胞の提供者に対する説明文書及び同意文書様式
- 再生医療等を受ける者に対する説明文書及び同意文書様式
- 再生医療等に用いる細胞に関する研究成果を記載した書類
- 記載された再生医療等と同様又は類似の再生医療等に関する国内外の実施状況(研究成果等)に関する資料
- 特定細胞加工物概要書、特定細胞加工物標準書、衛生管理基準書、製造管理基準書、品質管理基準書
- 再生医療等製品を当該承認の内容に従わず用いる場合にあっては、当該再生医療等製品の添付文書等記載事項を記載した書類
- 再生医療等の内容をできる限り平易な用語を用いて記載したもの
- 特定細胞加工物の製造を委託する場合にあっては、委託契約書の写し
- 個人情報取扱実施規程
- その他
健康被害補償措置の準備
- 再生医療等臨床研究保険への加入など、適切な補償措置を講じてください。
加入契約は再生医療等の提供開始前までに締結してください。 - 保険見積もり・加入の手続き窓口(学内のみ):
病院事務部 研究支援課倫理審査係(ウエストウイング棟6階 610)
TEL:092-642-5082(内線3982)
※学外の方は各施設の窓口にお問い合わせいただくか、日本再生医療学会が主導する「再生医療等臨床研究補償保険制度」など適宜保険への加入をご検討ください。
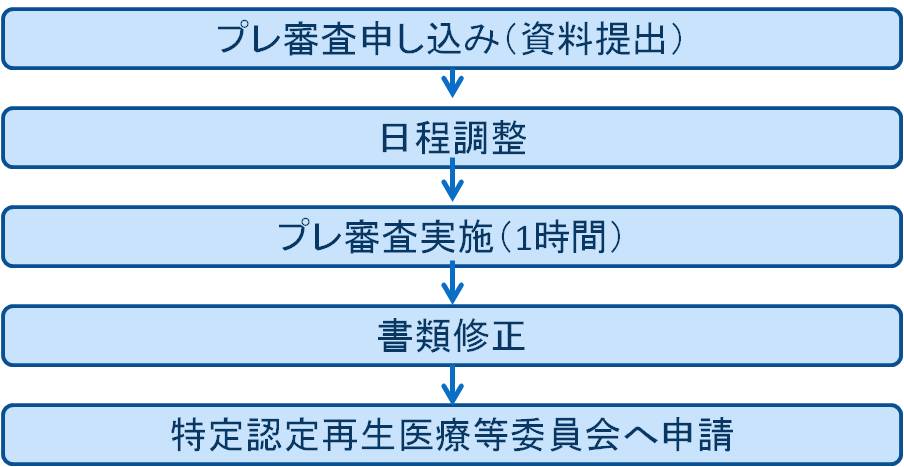
2. プレ審査
プレ審査申込み
九大内の研究者が主導する臨床研究はプレ審査が必須です。(多施設共同研究で、九大以外でプロトコルが作成されたものは対象外)学外については希望がある場合のみ実施します。
※プレ審査とは:
特定認定再生医療等委員会への申請前に、ARO次世代医療センターおよび100人部会から選出された専門医委員による審査を行い、プロトコール作成や実施に関する全般的アドバイス (科学的合理性、生物統計、同意説明文書作成支援など)を行います。
プレ審査資料提出
- 以下の書類をダウンロードし、作成してください。
①プレ審査依頼書
②申請書
③委員会申請用セルフチェックシート
④再生医療等提供基準チェックリスト(厚労省)
⑤審査手数料の支払経費に関する書類(学内のみ) - プレ審査資料を1部提出してください。
①プレ審査依頼書
②申請書
③セルフチェックシート
④審査手数料の支払経費に関する書類(学内のみ)
⑤再生医療等提供計画案および添付資料
※「1.再生医療等提供計画の作成」参照
⇒提出先:病院事務部 研究支援課倫理審査係(ウエストウイング6階 601)
TEL:092-642-6055(内線6055)
E-mail:byskenkyu@jimu.kyushu-u.ac.jp
プレ審査実施
- 日程調整のうえ、1時間ほどで実施します。
- プレ審査では、計画内容の疑義や問題点を協議します。
- プレ審査結果を踏まえ特定認定再生医療等委員会申請資料を最終化してください。
- 利益相反についてはプレ審査で審査しますが、追加の審議が必要と判断された場合は、臨床研究利益相反マネジメント委員会へ諮問します。
3. 特定認定再生医療等委員会申請
特定認定再生医療等委員会申請
- 開催前月の月末を〆切とし、受付より1か月以内に委員会を開催します。
⇒申請資料提出先:
〒812-8582 福岡市東区馬出3-1-1
九州大学病院 事務部研究支援課倫理審査係
TEL:092-642-5082 FAX:092-642-6024
※申請日時を事前にbyskenkyu@jimu.kyushu-u.ac.jpにご連絡ください。 - 特定認定再生医療等委員会開催2週間前頃に、日時、場所、説明者・陪席者の確認メールをお送りします。
特定認定再生医療等委員会申請資料
- 下記いずれかをダウンロードして、審査依頼書を作成してください。
- 上記依頼書と併せて、プレ審査で提出いただいた「申請書」および「審査手数料の支払経費に関する書類」と下記の書類を各1部提出してください。
- 再生医療等提供計画(厚労省様式1)
作成支援サイト:https://saiseiiryo.mhlw.go.jp/application/plan - 提供する再生医療等の詳細を記した書類
- 実施責任者及び再生医療等を行う医師/歯科医師の氏名、所属、役職及び略歴(研究実績があるには、その実績)を記載した書類
- 細胞の提供者に対する説明文書及び同意文書様式
- 再生医療等を受ける者に対する説明文書及び同意文書様式
- 再生医療等に用いる細胞に関する研究成果を記載した書類
- 記載された再生医療等と同様又は類似の再生医療等に関する国内外の実施状況(研究成果等)に関する資料
- 特定細胞加工物概要書、特定細胞加工物標準書、衛生管理基準書、製造管理基準書、品質管理基準書
- 再生医療等製品を当該承認の内容に従わず用いる場合にあっては、当該再生医療等製品の添付文書等記載事項を記載した書類
- 再生医療等の内容をできる限り平易な用語を用いて記載したもの
- 特定細胞加工物の製造を委託する場合にあっては、委託契約書の写し
- 個人情報取扱実施規程
- その他
- 再生医療等提供計画(厚労省様式1)
特定認定再生医療等委員会審査費の支払い
- 審査手数料の徴収方法について
【学内の研究者】
部局担当にて、ご指定頂きました財源により支払手続きを行います。
【学外の研究者】
特定認定再生医療等委員会への申請資料を提出後、「再生医療等提供計画の審査等業務に係る契約」を締結させて頂きます。
本契約に基づき、請求書を発行いたします。 - 審査手数料について
再生医療等の分類 手数料 本学が管理する経費
による場合左記以外の経費
による場合1年目
(第1種・第2種・第3種)380,000円 520,000円 2年目以降
(第1種・第2種・第3種)250,000円 320,000円
4. 特定認定再生医療等委員会審査
- 委員会は、審査依頼の都度日程調整し開催します。
- 説明者は申請資料に基づき、15分以内(時間厳守)で説明してください。スライド資料などの用意は不要です。
- 審査結果は、委員会審査終了後1か月以内に「認定再生医療等委員会意見書」(別紙様式第5)を実施責任者(多施設共同研究の場合は、統括責任者)へ送付します。
5. 再生医療等提供計画の提出
再生医療等提供計画の提出
- 特定認定再生医療等委員会での承認取得後、実施責任者(多施設共同治験の場合は統括責任者)より、再生医療等提供計画を厚生労働大臣又は地方厚生局長へ提出してください。
申請はWebsiteより行ってください。http://saiseiiryo.mhlw.go.jp/ - 提出資料は、委員会で承認を受けた再生医療等提供計画(様式1)および添付資料、認定再生医療等委員会意見書です。
再生医療等提供計画(様式1)は再生医療等提供機関管理者の捺印が必要です。九大内で実施の場合は、認定再生医療等委員会意見書と合わせて病院長捺印済書類を実施責任者へ送付します。
臨床試験登録について
- 臨床研究として再生医療等を実施する場合は、臨床試験登録が必要です。
臨床試験登録サイトには、以下のものなどがあります。
試験開始前までには必ず臨床試験情報を登録し、進捗に応じてアップデートしてください。
【日本(いずれか必須)】- UMIN (http://www.umin.ac.jp/)
- 日本医師会 (http://www.med.or.jp/)
- 日本医薬情報センター (http://www.japic.or.jp/)
【アメリカ】
- Clinical Trials gov. (https://clinicaltrials.gov/)
6. 再生医療等の実施
- 再生医療等提供計画届出受理後に臨床研究・診療を開始してください。
実施期間中は被験者の観察/評価以外に、以下の場合は特定認定再生医療等委員会への報告が必要です。- 再生医療等提供計画の変更等
- 有害事象報告
- 定期報告
7. 再生医療等の終了
- 必要な記録を整理して、保管してください。
記録事項:- 再生医療等を受けた者の住所、氏名、性別及び生年月日
- 病名及び主要症状
- 使用した特定細胞加工物等の種類、投与方法その他の再生医療等の内容及び評価
- 再生医療等に使用した細胞に関する情報(入手先、検査結果等)等
保存期間:
- 指定再生医療等製品又は指定再生医療等製品の原料と類似の原料からなる特定細胞加工物を用いる再生医療等に係る記録は30年間
- それ以外は10年間
8. 中止・終了報告
- 特定認定再生医療等委員会へ中止・終了報告を行ってください。
- 臨床試験登録サイトの情報を更新・結果の登録をしてください。
- 学外研究者においては、各施設の手続きに従った中止・終了報告も合わせて実施してください。
